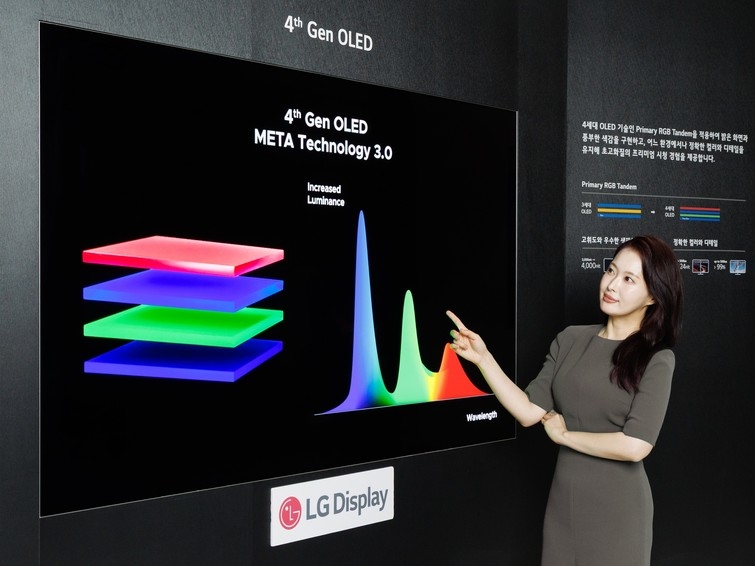
2025.9.23.
머크, 키트루다SC FDA 승인 여부

국내 기술로 면역 항암제를 1~2분만에 투여할 수 있는 피하(皮下) 주사제가 개발돼 미국 식품의약국(FDA)에서 허가를 받음. 파트너사 머크(MSD)의 ‘키트루다 큐렉스’가 승인된 것임.
키트루다 큐렉스 특징
- 정맥 주사(30분) → 피하 주사(1~2분)로 전환
- 3주 1회 1분, 6주 1회 2분 투약 가능
- 흑색종, 폐암, 자궁경부암 등 38개 적응증 허가
- 알테오젠 기술 ALT-B4 적용
ALT-B4 기술
히알루론산층을 분해해 약물이 빠르게 흡수되도록 하는 기술임. 정맥 주사를 피하 주사로 바꿀 수 있어 환자 편의성을 크게 향상시킴.
효능 동등성 검증
- 비소세포폐암 환자 대상 임상 3상 진행
- 정맥 주사와 피하 주사의 약동학 결과 유사
시장 확대 효과
피하 주사제는 환자가 집에서도 주사 가능해 시장 규모 확대 기대됨. 또한 오리지널 신약 기업은 동일 기술을 활용해 특허 연장 효과도 노릴 수 있음. 머크의 키트루다 특허는 2028년 만료 예정임.
국내 기업 사례
- 셀트리온: 레미케이드 바이오시밀러 램시마 IV(정맥 주사) 개발 → 램시마 SC(피하 주사)로 발전
- 램시마 SC는 미국 FDA 신약 승인 후 ‘짐펜트라’라는 이름으로 출시
알테오젠 글로벌 계약 현황
- 2020년: 머크와 ALT-B4 기술이전 계약 체결
- 2023년 2월: 머크와 6360억 원 규모 독점 계약
- 2023년 11월: 다이이찌산쿄와 4400억 원 규모 계약 (ADC 유방암 치료제 ‘엔허투’ 피하 제형 개발)
- 2024년 3월: 아스트라제네카와 1조8000억 원 규모 계약
종합 평가
알테오젠 기술은 글로벌 제약사들의 신약 개발과 시장 확대 전략에 핵심 역할을 하고 있음. 피하 주사제 보편화는 환자 편의성과 제약사의 수익성을 동시에 높이는 계기가 될 전망임.
알테오젠의 ALT-B4 기술을 활용한 키트루다 피하주사(SC)가 미국 FDA 승인을 앞둠.
MSD는 유럽폐암학회에서 임상 3상 결과 발표. 유효성과 안전성 모두 입증됨.
ALT-B4 기술 개요 및 기대 효과
알테오젠의 ALT-B4는 혈관주사 의약품을 피하주사로 전환 가능한 히알루로니다제 기술임.
자택 투약 가능, 환자 편의성 증대.
총 9조 원 규모 기술 수출 성과 보유.
향후 매출 및 로열티 수익 전망
MSD의 계획과 시장 전략
초기 암 환자 중심으로 SC 제형 사용 확대 계획.
유럽 시장에서도 내년 초 출시 목표.
SC 제형 시장 확대를 통한 키트루다 매출 극대화 전략 추진 중.
※ 해당 내용은 AI가 자동으로 작성·요약한 것이므로, 세부 내용은 실제 원문과 차이가 있을 수 있습니다. 보다 정확한 정보가 필요하다면 원문을 직접 확인해 주세요.